CASO 1:
CARCINOMA ADENO-ESCAMOSO DE BAJO GRADO, DE MAMA
Youssef Bouhajeb, María Teresa Miguel
Salas, José Luis Sarasa Corral
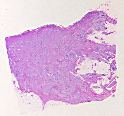
Mujer de 43 años. En de 1990 se le
practicó una mastectomía que incluía un tumor de 3´5 cm
blanquecino-grisáceo , estrellado y de bordes mal definidos. En la grasa
axilar, se aislaron 9 ganglios linfáticos que carecían de imágenes de
malignidad.
Esta tumoración mamaria nos planteó un
importante problema de diagnostico. Su morfología sugería un tumor
bifásico, con un componente epitelial dispuesto en trabéculas, ductos y
células sueltas, cuyos elementos mostraban citoplasma eosinófilo. Con gran
frequencia, acompañaba una reacción estromal circular y celular. Entre
estos componentes aparecían acinos y ductos preexistentes. Existía alguna
invasión perineural y focos inflamatorios linfoplasmocitários.
En aquel momento no fuimos capaces de
asociar esta morfología con un tipo tumoral definido. Por ello, enviamos
el caso al Dr Battifora, y los miembros de su grupo emitieron diagnósticos
muy dispares, reflejando la dificultad del diagnóstico. Tres patólogos
pensaron en carcinoma tubular, uno carcinoma, uno fibroadenoma like
esclerosante, otro mastopatía autoinmune, y el ultimo "peculiar pero
benigno".
El grupo del doctor Battifora refirió a
su vez el caso al Dr Rosen quién lo diagnosticó de carcinoma adeno-escamoso
de bajo grado.
Tras ese diagnóstico la paciente no
recibió tratamiento quimio ni radioterápico. En noviembre del año 2000 se
le hizo la última revisión persistiendo, a los 10 años de la intervención,
en buen estado general, sin ningún signo de recidiva o metástasis.
El carcinoma adeno-escamoso de bajo
grado de la mama es un tumor raro que conviene conocer dada su especial
morfología. Consiste en una variante de carcinoma mamario metaplásico
formado por mezcla de componentes glandular y escamoso, en el que es
característico el crecimiento localmente invasivo y el bajo riesgo de
metastatizar. En dos publicaciones dedicadas a esta entidad se recogen los
datos de 32 pacientes (ROSEN and ERNSBERGER, 1987) (van HOEBEN et al,
1993). Aparece en mujeres con edad media de 57 años (33-88), y suele
presentarse como masa palpable, siendo el CSE la localización más
frecuente.
Macroscópicamente se manifiestan con
bordes poco definidos, con diámetro medio de 2.8 cm (0.6-0.8 cm), y la
superficie de corte es grisácea y firme. En estas neoplasias no se
describe conexión con la piel.
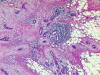
Microscópicamente constan de pequeñas
estructuras glandulóides infiltrantes, con variable diferenciación
epidermóide, con luces alargadas, ovoides o comprimidas, rodeadas por
estroma conectivo. Tienden a crecer rodeando ductos y lóbulos. Imitan a
los elementos del carcinoma tubular, pero sus contornos tienden a ser
redondeados, no angulados. La cantidad de diferenciación escamosa varía,
así como el componente inflamatorio linfocitario estromal. Los receptores
de estrógenos y progesterona suelen ser negativos, pues no más del 5% de
los núcleos de sus células presentan inmunopositividad (DRUDIS et al,
1994).
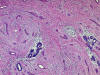
El estroma varía de fibroso a basófilo o
edematoso, y raramente (2 de 32 casos) aparece metaplasia osteo-cartilaginosa
estromal. En la periferia del tumor las estructuras mamarias normales
pueden aparecer infiltradas, pero persisten vivaces. La atípia y mitosis
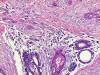
suelen ser escasas y no presentan necrosis. En ocasiones, el carcinoma
adeno-escamoso de bajo grado aparece relacionado con lesiones
esclerosantes complejas tipo cicatriz radial esclerosante (DENLEY et al,
2000).
El pronóstico es bueno. La tumorectomía
puede seguirse de recidiva local. Las pacientes no suelen desarrollar con
frecuencia metástasis ganglionares o sistémicas (solo en dos casos de los
32 descritos). La posibilidad de recidiva local indica la necesidad de un
tratamiento local adecuado (amplia escisión local o cuadrantectomía). Los
tumores mayores de 3 cm pueden requerir una terapia más agresiva.
BIBLIOGRAFÍA.
ROSEN PP, ERNSBERGER D. Low-grade
adenosquamous carcinoma. A variant of mataplastic mammary carcinoma.
Am J Surg Pathol 1987; 11: 351-358
Van HOEVEN KH, DRUDIS T, CRANOR ML,
et al. Low-grade adenosquamous carcinoma of the breast. A
clinicopathologic study of 32 cases whith ultrastructural analysis. Am
J Surg Pathol 1993;17: 248-258
DRUDIS T, ARROYO C, VAN HOEVEN K,
CORDON-CARDO C, ROSEN PP. The pathology of low-grade adenosquamous
carcinoma of the breast. An imnunohistochemical sudy. Pathology Annual
1994 (2); 29: 181-197
DENLEY H, PINDER SE, TAN PH et al.
Metaplastic carcinoma of the breast arising within complex sclerosing
lesion: a report of five cases. Histopathology 2000; 36: 203-209
Mª Teresa Miguel Salas, Youssef Bouhajeb, José
Luis Sarasa Corral
Hombre de 79 años. Historia de 15 días de
evolución de molestias digestivas, colestasis, coluria y acolia. El TAC revela
masa intravesicular. Colecistectomía.
ESTUDIO ANATOMOPATOLÓGICO
Descripción Macroscópica:
Pieza de colecistectomía que se recibe
abierta y mide 8 x 8 cm de superficie; superficie externa lisa y congestiva
con un área abollonada e indurada próxima al cuello de 2.5 x 2 cm. En la
superficie mucosa se aprecia una neoformación polipoide y rojiza, sesil
subyacente al área descrita externamente, que mide 2.5 x 2 x 1.5 cm. La
formación queda a 2 cm del borde de resección del cístico. Al corte aparece
constituida por tejido blanquecino-grisáceo, firme y elástico, homogénea,
alcanzado 1.5 cm de espesor máximo. En profundidad parece contactar con la
serosa, sin infiltrarla.
El resto de la mucosa vesical presenta
superficie fibrilar por aplanamiento de pliegues y color pardo.
Descripción Microscópica:
La neoformación está constituida por una
proliferación de células fusiformes y epitelioides predominando éstas últimas
en las zonas más superficiales. Las células muestran citoplasma eosinófilo
amplio, nucleolos muy prominentes y actividad mitótica moderada-alta (hasta 3
mitosis en un solo campo de gran aumento). Acompañan células bizarras.
Focalmente existe pigmento melánico en las células neoplásicas y en
melanófagos. La neoformación se extiende desde la mucosa y en profundidad
infiltra todas las capas de la vesícula hasta la serosa. Se observan
infiltraciones perineurales y de la pared de una estructura venosa. Acompañan
focos de necrosis y moderada reacción desmoplásica. Borde de resección del
cístico: libre. Resto de la pared vesical, cuerpo y fondo con discreta
fibrosis y leve reacción inflamatoria inespecífica.
Estudio Inmunohistoquímico:
Vimentina: intensa positividad en células
tumorales.
S-100: abundante positividad.
HMB-45: focos de positividad.
AE1/AE3: negativa en células tumorales.
MIB1: abundante actividad proliferativa,
aproximadamente 10-20 %.
DIAGNÓSTICO
Melanoma de células fusiformes y
epitelioides que infiltra todas las capas de la vesícula hasta la serosa.
COMENTARIO
Ante este diagnóstico, nos planteamos si se
trataba de un melanoma en vesícula biliar primario o metastásico, ya que éstos
últimos tienen una supervivencia media menor que los primarios (metastásicos:
4.8 meses; primarios: 20.4 meses). Para hablar de melanoma en vesícula biliar
primario se manejan tres criterios que deben cumplirse simultáneamente y que
son:
Tumor solitario.
Tumor que surja de la mucosa en forma
papilar o polipoide.
Actividad juntural evidente o que quede
descartado otra localización primaria.
Decimos que los tres criterios tienen que
cumplirse a la vez porque, por ejemplo, hay casos descritos de melanomas
metastásicos en vesícula biliar en los que se ha descrito la presencia de
actividad juntural.
En nuestro caso, no conseguimos ver la
actividad juntural y remitimos al paciente al Servicio de Dermatología de
nuestro hospital, donde se descartó que tuviera o hubiera tenido alguna lesión
cutánea primaria.
Después de haber revisado varios trabajos
sobre el tema y para concluir, podemos quedarnos con tres ideas:
Los melanomas en vesícula biliar tanto
primarios como metastásicos son muy raros, pero son más frecuentes los
metastásicos.
Son más frecuentes en varones.
Son más frecuentes en edades medias (4ª-5ª
década).
BIBLIOGRAFIA
DONG XD. Cancer 1999 (Jan 1); 85 (1):
32-39.
HEATH DI. J Clin Pathol 1988 (Oct.); 41:
1073-1077.
VERBANCK JJ. Gastroenterology 1986 (Jul);
91: 214-218.
BORJA SR. Cancer 1984 (Sept 1); 54 (5):
929-931.
PEISON B. Cancer 1976 (May); 37 (5):
2448-2454.
VELEZ AF. Am Surg 1995 (Dec); 61 (12):
1095-1098.
GUERINI A. Arch Anat Cytol Pathol 1990; 38
(4): 168-170.
HATAE Y. Pathol Res Pract 1978 (Nove); 163
(3): 281-287.
NAGUIB SE. Am J Dermatopathol 1984 (Summer);
6 Suppl: 231-243.
SIERRA-CALLEJAL JL. Virchows Arch A
Patholg Anat Histol 1976 (Jun 22); 370 (3): 233-238.